NEUTRALIZACION Y PH
ZAMANTA LEMUS ZAPATA
PRESENTADO A LA DOCENTE: DIANA FERNANDA JARAMILLO
CÁRDENAS
EN LA ASIGNATURA DE: QUÍMICA
GRADO:10-3
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
IBAGUE-TOLIMA
2018
INTRODUCCIÓN
- Al realizar el análisis de este trabajo busco ampliar los conocimientos sobre que es la neutralizacion y ph
- Considero muy interesante conocer la importancia de estos conceptos, y estar informados acerca de ellos y así relacionarlos en nuestra vida cotidiana.
- Conoceremos las características y definiciones de la neutralizacion y el ph
- Durante el transcurso de este trabajo he ido profundizando en este tema y es por que considero muy importante investigar sobre todo esto
OBJETIVOS
- Brindar un patrón para explicar las propiedades de la neutralizacion y ph ,y la relación que existe entre ellas.
- Conocer cuáles son las características de la neutralizacion y ph
- Cuales son sus tipos de aplicación en la actualidad, como se da su proceso de inicialización.
- Analizar si la neutralizacion y el ph son más de beneficio o perjuicio para la humanidad en la actualidad.
- MARCO TEÓRICO:
Una reacción de neutralizacion se lleva a cabo al combinar un ácido con una base en general producen un hidróxido formando agua y sal.
Este tipo de reacción se le conoce como reacción de doble sustitución o reacción de metasis, esto es por que intercambian parejas de iones.
Este tipo de reacciones son especialmente útiles como técnicas de análisis cuantitativo, En este caso se puede usar una solución indicadora para conocer el puro en el que se ha alcanzado la neutralizacion completa. Algunos indicadores son la fenolftaleina, azul de safranina, el azul de metileno, etc.
Existen también método electroquimicos para lograr este propósito como el uso de un phmetro o la conductimetria.
Para medir el pH se pueden utilizar algunas sustancias (indicadores ácido-base) que son sensibles a la concentración de iones hidrógeno. Estas sustancias dependiendo de la acidez o basicidad del medio, cambian de color a valores de pH específicos. Algunos indicadores son de origen animal y otros pueden ser de origen vegetal. Cada uno de los colorantes tienen un color en medio ácido y otro en medio básico o alcalino. Un ejemplo puede ser el tornasol, que presenta un color rojo en soluciones ácidas y un color azul en soluciones alcalinas. La combinación de una serie de indicadores impregnados en un papel conocido como papel pH, presentan una gama de colores que se pueden observar conforme varía la concentración de iones hidrógeno.
- PROCEDIMIENTO:
- ¿Que es Neutralizacion?
- Características de la neutralizacion
- Titulación
- Productos de una reacción de neutralizacion
- Ejemplo
- ¿Que es ph?
- Características del ph
- El ph en el cuerpo humano
- El ph en el agua
- Escala del ph
- Ejercicios
¿QUE ES NEUTRALIZACION?
Una reacción ácido-base o reacción de neutralización es una reaccion química que ocurre entre un acido y una base produciendo una sal y agua.
La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+ del NaOH) y cuyo anión provenga de un ácido (Cl- del HCl). Las reacciones de Neutralización son generalmente exoftálmicas, lo que significa que desprenden energía en forma de calor. Se les suele llamar de neutralización porque al reaccionar un ácido con una base, estos neutralizan sus propiedades mutuamente.
Existen varios conceptos que proporcionan definiciones alternativas para los mecanismos de reacción involucrados en estas reacciones, y su aplicación en problemas en disolución relacionados con ellas. La palabra neutral se puede interpretar como aniquilación o como eliminación, lo cual no está muy lejano a la realidad. Cuando un ácido se mezcla con una base ambas especies reaccionan en diferentes grados que dependen en gran medida de las concentraciones y volúmenes del ácido y la base a modo ilustrativo se puede considerar la reacción de un ácido fuerte que se mezcla con una base débil, esta última será neutralizada completamente, mientras que permanecerá en disolución una porción del ácido fuerte, dependiendo de las moles que reaccionaron con la base. Pueden considerarse tres alternativas adicionales que surgen de la mezcla de un ácido con una base:
- Se mezcla un ácido Fuerte con una base fuerte: Cuando esto sucede, la especie que quedará en disolución será la que esté en mayor cantidad respecto de la otra.
- Se mezcla un ácido débil con una base fuerte: La disolución será básica, ya que será la base la que permanezca en la reacción
- Se mezcla un ácido débil con una base débil: Si esto sucede, la acidez de una disolución dependerá de la constante de acidez del ácido débil y de las concentraciones tanto de la base como del ácido.
A pesar de las diferencias en las definiciones, su importancia se pone de manifiesto en los diferentes métodos de análisis, cuando se aplica a reacciones ácido-base de especies gaseosas liquidas, o cuando el carácter ácido o básico puede ser algo menos evidente. El primero de estos conceptos científicos de ácidos y bases fue proporcionado por el químico francés Antonie Lavoisier, alrededor de 1776.1
CARACTERÍSTICAS DE LA NEUTRALIZACION
En primer lugar, se debe enfatizar que si una reacción de neutralización se inicia con cantidades iguales del ácido y de la base (en moles), cuando finaliza dicha reacción se obtiene solamente una sal; es decir, no hay cantidades residuales de ácido o base.
Además, una propiedad muy importante de las reacciones ácido-base es el pH, el cual indica qué tan ácida o básica es una solución. Este se determina por la cantidad de iones H+ que se encuentran en las soluciones medidas.
Por otro lado, existen varios conceptos de acidez y basicidad dependiendo de los parámetros que se tomen en consideración. Un concepto que destaca es el de Brønsted y Lowry, que considera un ácido como una especie capaz de donar protones (H+) y una base como la especie capaz de aceptarlos.
- TITULACIÓN:
Para estudiar apropiadamente y de manera cuantitativa una reacción de neutralización entre un ácido y una base se aplica una técnica llamada titulación (o valoración) ácido-base.
Las titulaciones ácido-base consisten en determinar la concentración de ácido o base necesaria para neutralizar una cantidad determinada de base o ácido de concentración conocida.
En la práctica, se debe añadir gradualmente una solución patrón (cuya concentración se conoce con exactitud) a la solución cuya concentración se desconoce hasta que se alcance el punto de equivalencia, donde una de las especies ha neutralizado de manera completa a la otra.
El punto de equivalencia se detecta mediante el cambio violento de color del indicador que se ha añadido a la solución de concentración desconocida cuando se ha completado la reacción química entre ambas soluciones.
Por ejemplo, en el caso de la neutralización del ácido fosfórico (H3PO4) habrá un punto de equivalencia por cada protón que se desprenda del ácido; es decir, se tendrán tres puntos de equivalencia y se observarán tres cambios de coloración.
- PRODUCTOS DE UNA REACCIÓN DE NEUTRALIZACION
En las reacciones de un ácido fuerte con una base fuerte se lleva a cabo la neutralización completa de las especies, como en la reacción entre el ácido clorhídrico y el hidróxido de bario:
2HCl(ac) + Ba(OH)2(ac) → BaCl2(ac) + 2H2O(l)
Así que no se generan iones H+ u OH– en exceso, lo cual significa que el pH de las soluciones de electrolitos fuertes que se han neutralizado está intrínsecamente relacionado con el carácter ácido de sus reactantes.
Por el contrario, en el caso de la neutralización entre un electrolito débil y uno fuerte (ácido fuerte + base débil o ácido débil + base fuerte) se obtiene la disociación parcial del electrolito débil y aparece la constante de disociación del ácido (Ka) o de la base (Kb) débil, para determinar el carácter ácido o básico de la reacción neta mediante el cálculo del pH.
Por ejemplo, se tiene la reacción entre el ácido cianhídrico y el hidróxido de sodio:
HCN(ac) + NaOH(ac) → NaCN(ac) + H2O(l)
En esta reacción el electrolito débil no se ioniza notablemente en la solución, por lo que se representa la ecuación iónica neta de la siguiente manera:
HCN(ac) + OH–(ac) → CN–(ac) + H2O(l)
Esta se obtiene luego de escribir la reacción con los electrolitos fuertes en su forma disociada (Na+(ac) + OH–(ac) en el lado de los reactantes, y Na+(ac) + CN–(ac) en el lado de los productos), donde solo el ion sodio es un espectador.
Finalmente, en el caso de la reacción entre un ácido débil y una base débil no se produce dicha neutralización. Esto se debe a que ambos electrolitos se disocian de manera parcial, sin dar como resultado el agua y la sal esperados.
- EJEMPLOS
- Ácido fuerte + base fuerte
Se tiene como ejemplo la reacción dada entre el ácido sulfúrico y el hidróxido de potasio en medio acuoso, según la siguiente ecuación:
H2SO4(ac) + 2KOH(ac) → K2SO4(ac) + 2H2O(l)
Puede observarse que tanto el ácido como el hidróxido son electrolitos fuertes; por lo tanto, se ionizan completamente en la solución. El pH de esta solución dependerá del electrolito fuerte que esté en mayor proporción.
A continuación se presentan dos gráficas en las que se observa la titulación de la reacción de neutralización de un ácido fuerte con una base fuerte y de una base fuerte con un ácido fuerte, donde se representa también su punto de equivalencia:
- Ácido fuerte + base débil:
La neutralización del ácido nítrico con el amoníaco da como resultado el compuesto nitrato de amonio, como se muestra a continuación:
HNO3(ac) + NH3(ac) → NH4NO3(ac)
En este caso no se observa el agua producida junto a la sal, debido a que se tendría que representar como:
HNO3(ac) + NH4+(ac) + OH–(ac) → NH4NO3(ac) + H2O(l)
De modo que sí puede observarse el agua como producto de la reacción. En este caso, la solución tendrá un pH esencialmente ácido.
- Ácido débil + base fuerte
Seguidamente se muestra la reacción que se da entre el ácido acético y el hidróxido de sodio:
CH3COOH(ac) + NaOH(ac) → CH3COONa(ac) + H2O(l)
Como el ácido acético es un electrolito débil se disocia parcialmente, dando como resultado acetato de sodio y agua, cuya solución tendrá un pH básico.
- Ácido débil + base débil:
Por último y como se dijo anteriormente, una base débil no puede neutralizar un ácido débil; tampoco sucede al contrario. Ambas especies se hidrolizan en solución acuosa y el pH de la solución dependerá de la “fuerza” del ácido y de la base.
¿QUE ES PH ?
Se habla en muchos sitios de como afecta el PH a nuestro organismo. Que debemos tener una dieta alcalina. Que beber agua alcalina es beneficiosa para nuestra salud. Intentaremos empezar por el principio, explicando que es el PH y como debemos tenerlo en cuenta.
El PH es el Potencial de Hidrógeno. Es una medida para determinar el grado de alcalinidad o acidez de un disolución. Con el PH determinamos la concentración de hidrogeniones en una disolución. Un hidrogenión es un ion positivo de Hidrógeno, es un “cachito con carga positiva” del Hidrógeno.
La formula matemática para calcular el PH es el logaritmo negativo en base 10 de la actividad de los iones hidrógeno. pH = –log[aH+]
Es decir, será mas ácido cuantos más actividad de “cachitos con cargas positivas” de Hidrógeno exista en la disolución. Cuando haya menos actividad la muestra, sera alcalina.
¿Como se mide el ph?
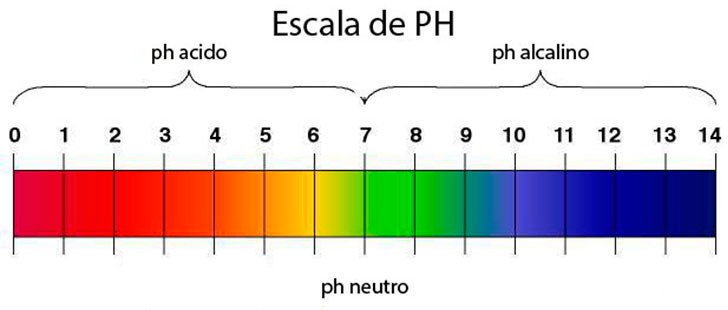
El PH normalmente lo medimos en una escala de 1 a 14. El uno seria el valor mas ácido. El 14 el valor mas alcalino. Y el 7 el valor neutro. Normalmente se usan 2 tipos de instrumentos para medir el PH.
Reactivos de ph:
Los reactivos de PH los podemos encontrar en tiras o en gotitas. Su uso es muy fácil. Se echan algunas gotitas en la muestra y dependiendo del color que coja el liquido podremos determinar si es ácido, alcalino o neutro. Con las tiras el procedimiento es muy similar, hay que mojar las tiras y cambiaran de color. Es muy fácil utilizar y para empezar siempre recomendamos este método
El ph metro:
El PH-metro es un potenciómetro que mide el PH entre dos electrodos. Un electrodo suele ser de plata o cloruro de plata y el otro suele ser vidrio que es sensible a los hidrogeniones.


- CARACTERÍSTICAS:
El pH es una característica de todas las sustancias determinadas por la concentración de iones de hidrógeno (H +). Cuanto menor es el pH de una sustancia, mayor es la concentración de iones H + y menor la concentración de iones OH-.
lo que hace que la clasificación de un medio siga estos principios:
- Medio ácido: Concentración de hidronios> (mayor) que la de hidróxidos.
- Medio neutro: Concentración de hidronios = (igual) a de hidróxidos.
- Medio básico: Concentración de hidronios < (menor) que la de hidróxidos.
Los valores de pH varían de 0 a 14, los valores por debajo de 0 y por encima de 14 son posibles, pero muy raros y no se pueden medir con los aparatos convencionales.
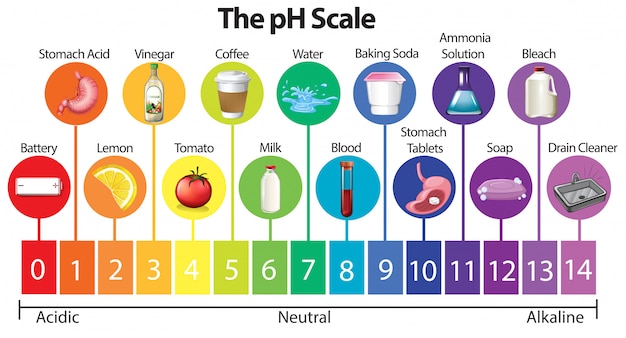
- PH EN EL CUERPO HUMANO:
Depende, y decimos depende porque cada parte del cuerpo suele tener un PH diferente. Nuestro cuerpo esta continuamente generando hidrogeniones. Ponemos algunos ejemplos:
- Sangre: Suele estar entre 7,35 y 7,45. Por encima o debajo de estos valores, tendríamos algún problema de salud.
- Piel: Suele tener un PH de 5,5.
- Jugos Gástricos: Su PH suele tener un valor de 1,5.
El Ph del liquido extracelular (como la sangre) es ligeramente alcalino. Nuestro cuerpo no puede permitirse cambios bruscos en el PH extracelular por ello existen mecanismos para proteger nuestro organismo y mantenerlo estable.
- PH E EL AGUA:
El agua no es mas que una disolución de un disolvente (H2O) con minerales. Como toda disolución, se le puede calcular el PH en función de la cantidad de hidrogeniones H(+) que tenga el liquido.
Como hemos visto anteriormente el agua puede ser ácida, neutra o alcalina
Partamos desde el principio. El agua se considera potable entre un PH de 6,5 y 9,5. Hoy en día podemos leer que numerosos sitios que el agua alcalina es lo mejor para salud. Que gracias a ella podemos neutralizar los principales ácidos del organismo. Es mas hidratante etc.
Como hemos visto anteriormente, un liquido es alcalino cuando este tiene pocos hidrogeniones.
- ESCALA DEL PH:
La escala del pH va desde 1, para las sustancias más ácidas, hasta 14 para las sustancias más alcalinas. El pH neutro, es el 7 y corresponde al agua destilada. Los colores de la escala pH sólo dependen del patrón que se esté utilizando.
PH ÁCIDO:
- Son llamadas sustancias ácidas, que son las sustancias que tienen un pH menor que 7 tienen una serie de propiedades comunes que las hacen muy fácil de distinguir:
- Las sustancias ácidas tienen sabor agrio o ácido, como los cítricos, el vinagre, o la aspirina (ácido acetil salicílico).
- Reaccionan con las bases (sustancias alcalinas) en reacciones ácido – base, dando una sal y agua.
- Los ácidos reaccionan con metal formando sal e hidrógeno, H2. Hay que tener cuidado en la reacción de un ácido con un metal por esta generación de hidrógeno. Aquí puedes ver la reacción entre Al y HCL.
- Con óxidos metálicos reaccionan para producir una sal y agua. De esta forma los ácidos suelen ser buenos para la limpieza de la corrosión.
- Producen quemaduras en la piel.
- Conducen la electricidad en disolución
PH ALCALINO:.
- Las sustancias con pH mayor que 7, son las llamadas sustancias alcalinas o básicas y tienen también características comunes, que son:
- Las sustancias alcalinas se disuelven en agua.
- Reaccionan con los ácidos en las llamadas reacciones ácido – base, dando de resultado una sal y agua.
- Tienen un sabor algo amargo
- Son conductores eléctricos
- Disuelven la grasa, y por ello son utilizados en jabones. Pero un pH elevado es irritante para la piel
- EJERCICIOS:
NEUTRALIZACION:
1.
2.
3.
4.
PH






LOS INFORMES ERAN POR SEPARADO Y FALTO EJERCICIOS DE NEUTRALIZACION 3,6
ResponderEliminar