ALCOHOLES Y FENOLES
ZAMANTA LEMUS ZAPATA
PRESENTADO A LA DOCENTE: DIANA FERNANDA JARAMILLO
CÁRDENAS
EN LA ASIGNATURA DE: QUÍMICA
GRADO:11-3
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
IBAGUE-TOLIMA
2018
INTRODUCCIÓN
- Los alcoholes son compuestos orgánicos.
- Recibe el nombre de fenol, el alcohol monohidroxílico derivado del benceno.
- Se le nombra fenol a todos los compuestos que tengan un radical oxidrílico unido al anillo bencénico
OBJETIVOS
- Saber como se nombran los alcoholes y fenoles
- Aprender a clasificar los Alcoholes y fenoles
- Identificar como se numeran .
- Conocer el criterio de clasificación de los alcoholes
- Conocer la diferente nomenclatura
MARCO TEÓRICO
Los alcoholes son una serie de compuestos que poseen un grupo hidroxilo, -OH, unido a una cadena carbonada; este grupo OH está unido en forma covalente a un carbono con hibridación. Cuando un grupo se encuentra unido directamente a un anillo aromático, los compuestos formados se llaman fenoles y sus propiedades químicas son muy diferentes.
En el laboratorio los alcoholes son quizá el grupo de compuestos más empleado como reactivos en síntesis.
Los alcoholes tienen uno, dos o tres grupos hidróxido (-OH) enlazados a sus moléculas, por lo que se clasifican en monohidroxílicos, dihidroxílicos y trihidroxílicos respectivamente. El metanol y el etanol son alcoholes monohidroxílicos. Los alcoholes también se pueden clasificar en primarios, secundarios y terciarios, dependiendo de que tengan uno, dos o tres átomos de carbono enlazados con el átomo de carbono al que se encuentra unido el grupo hidróxido. Los alcoholes se caracterizan por la gran variedad de reacciones en las que intervienen; una de las más importantes es la reacción con los ácidos, en la que se forman sustancias llamadas ésteres, semejantes a las sales inorgánicas. Los alcoholes son subproductos normales de la digestión y de los procesos químicos en el interior de las células, y se encuentran en los tejidos y fluidos de animales y plantas.
Los alcoholes son el grupo de compuestos químicos que resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH) en los hidrocarburos saturados o no saturados.
Alcoholes primarios, secundarios y terciarios.
- ALCOHOL PRIMARIO:
Físicamente son como los demás alcoholes, y sus puntos de ebullición o fusión dependen del grado de sus ramificaciones; pero químicamente, son los demás reactivos. Ademas, su acidez es superior a la de los alcoholes secundarios y terciarios.
Los alcoholes primarios experimentan reacciones de oxidación, convirtiéndose en un amplio números de compuestos orgánicos: esteres y éteres, aldehídos carboxilicos asimismo, pueden sufrir reacciones de deshidratacion, transformándose en alquenos y olefinas.
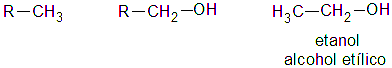
ESTRUCTURA:
Los alcoholes primarios derivados de alcanos lineales son los más representativos. Empero, en la realidad cualquier estructura, sea lineal o ramificada, puede clasificarse dentro de este tipo de alcoholes siempre y cuando el grupo OH esté enlazado a un CH2.
Entonces, estructuralmente todos tienen en común la presencia del grupo –CH2OH, llamado metilol. Una característica y consecuencia de este hecho es que el grupo OH se encuentra menos impedido; esto es, puede interactuar con el medio sin que otros átomos estorben especialmente.
Asimismo, un OH menos impedido significa que el átomo de carbono que lo porte, el del CH2, puede sufrir reacciones de sustitución mediante un mecanismo SN2 (bimolecular, sin la formación de un carbocatión).
Por otro lado, un OH con mayor libertad de interactuar con el medio, se traduce como interacciones intermoleculares más fuertes (por puentes de hidrógeno), lo que a su vez incrementan los puntos de fusión o ebullición.
Igualmente sucede con su solubilidad en solventes polares, siempre y cuando el grupo R no sea muy hidrofóbico.
PROPIEDADES:
- Acidez:
La carga negativa del RO–, específicamente del RCH2O–, siente menos repulsión por parte de los electrones de los dos enlaces C-H, que por los electrones del enlace C-R.
El grupo alquilo ejerce entonces la mayor repulsión, desestabilizando RCH2O–; pero no tanto en comparación a que si hubiera dos o tres grupos R, como ocurre con los alcoholes secundarios y terciarios, respectivamente.
Otra manera de explicar la mayor acidez de un alcohol primario, es mediante la diferencia de electronegatividad, creándose el momento dipolar: H2Cδ+-Oδ-H. El oxígeno atrae densidad electrónica tanto del CH2 como del H; la carga parcial positiva del carbono repele un poco la del hidrógeno.
El grupo R transfiere un poco de su densidad electrónica al CH2, lo cual ayuda a disminuir su carga parcial positiva y con ello su repulsión por la carga del hidrógeno. Mientras más grupos R haya, menor será la repulsión, y por ende, la tendencia del H a liberarse como H+.
REACCIONES QUIMICAS:
Los alcoholes reaccionan con los halogenuros de hidrógeno para producir halogenuros de alquilo. La reactividad de los alcoholes delante los halogenuros de hidrógeno, desciende en el orden siguiente:
Otra forma de preparar halogenuros de alquilo es mediante la reacción del cloruro de tionilo, un reactivo sintético, con un alcohol primario que se convierte en un cloruro de alquilo. El cloruro de tionilo (SOCl2) requiere para reaccionar la presencia de la piridina.
CH3(CH2)3CH2OH + SOCl2 => CH3(CH2)3CH2Cl + SO2 + HCl
Esta reacción corresponde a la halogenacion del 1-pentanol para convertirse en 1-cloropentano en presencia de piridina.
- OXIDACIÓN DE LOS ALCOHOLES PRIMARIOS:
Los alcoholes pueden ser oxidados a aldehídos y a ácidos carboxílicos, dependiendo del reactivo. El clorocromato de piridinio (PCC) oxida al alcohol primario a aldehído, usando como solvente el diclorometano (CH2Cl2):
CH3(CH2)5CH2OH => CH3(CH2)5COH
Esta es la oxidación del 1-heptanol en 1-heptanal.
Mientras, el permanganato de potasio (KMnO4) oxida primeramente el alcohol a aldehído, y seguidamente oxida al aldehído a ácido carboxílico. Cuando se utiliza el permanganato de potasio para oxidar los alcoholes debe evitarse la ruptura del enlace entre los carbonos 3 y 4.
CH3(CH2)4CH2OH => CH3(CH2)4COOH
Esta es la oxidación del 1-hexanol a ácido hexanoico.
Por este método es difícil obtener un aldehído, ya que este se oxida fácilmente a un ácido carboxílico. Una situación parecida se observa cuando se utiliza el ácido crómico para oxidar los alcoholes.
- FORMACIÓN DE ÉTERES:
Los alcoholes primarios pueden convertirse en éteres al ser calentado en presencia de un catalizador, generalmente ácido sulfúrico:
2 RCH2OH => RCH2OCH2R + H2O
- FORMACIÓN DE ESTERES ORGÁNICOS:
La condensación de un alcohol y un ácido carboxílico, esterificación de Fisher, catalizada por un ácido, produce un ester y agua:
R’OH + RCOOH <=> RCOOR’ + H2O
Una reacción muy conocida es la del etanol con el ácido acético, para dar acetato de etilo:
CH3CH2OH + CH3COOH <=> CH3COOHCH2CH3 + H2O
El alcohol primario es el más susceptible a sufrir reacciones de esterificación de Fischer.
- DESHIDRATACION
A temperaturas elevadas y en un medio ácido, generalmente de ácido sulfúrico, los alcoholes se deshidratan para originar alquenos con la pérdida de una molécula de agua.
CH3CH2OH => H2C=CH2 + H2O
Esta es la reacción de deshidratación del etanol a etileno. Una fórmula general más adecuada para este tipo de reacción, específicamente para un alcohol primario, sería:
RCH2OH => R=CH2 (lo que también es igual a RC=CH2)
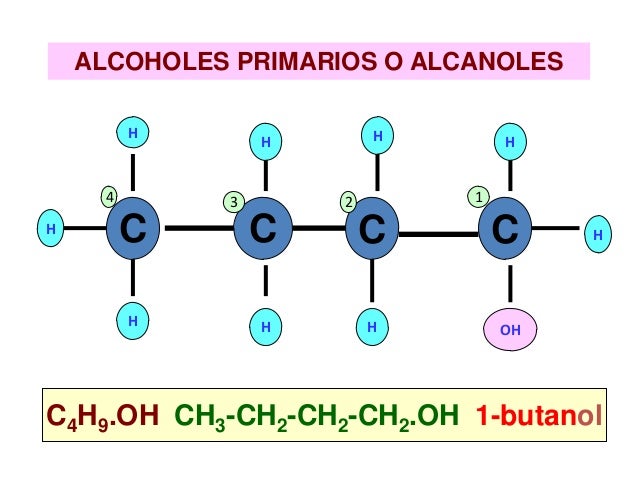
NOMENCLATURA
Las reglas para nombrar a un alcohol primario son las mismas que para los otros alcoholes; con la excepción, de que a veces no es necesario enumerar al carbono portador del OH.
En la imagen superior se tiene una cadena principal de siete carbonos. Al carbono enlazado con el OH se le asigna el número de 1, y entonces se empieza a contar de izquierda a derecha. Su nombre IUPAC por tanto es: 3,3-dietilheptanol.
Nótese que este es un ejemplo de un alcohol primario altamente ramificado.
- ALCOHOL SECUNDARIO:
Un alcohol secundario tiene el carbono portador del grupo hidroxilo (OH), unido a dos carbonos. Mientras, en el alcohol primario el carbono portador del grupo hidroxilo está unido a un átomo de carbono, y en el alcohol terciario unido a tres átomos de carbonos.
Los alcoholes son ácidos ligeramente más débiles que el agua, con los pKa siguientes: agua (15,7); alcoholes metílico (15,2), etílico (16), isopropílico (alcohol secundario, 17), y terbutílico (18). Como puede verse, el alcohol isopropílico es menos ácido que los alcoholes metílico y etílico.
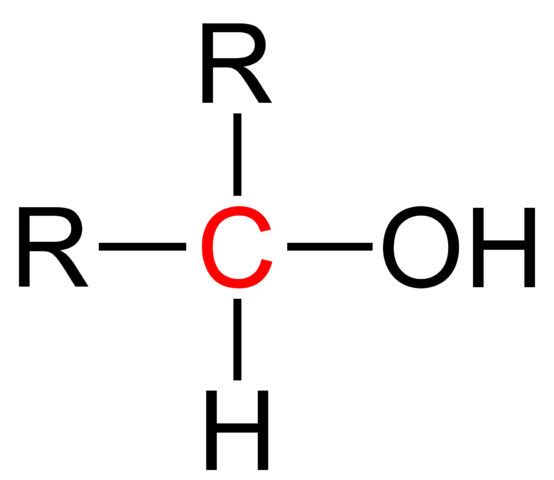
Todos los alcoholes tienen la fórmula genérica ROH; pero si se observa en detalle al carbono portador, entonces se obtienen los alcoholes primarios (RCH2OH), secundarios (R2CHOH, aquí planteados), y terciarios (R3COH). Este hecho marca una diferencia en sus propiedades físicas y reactividad.
- ESTRUCTURA:
Las estructuras de los alcoholes dependen de la naturaleza de los grupos R. No obstante, para los alcoholes secundarios se puede hacer cierta ejemplificación, considerando que solo puede haber estructuras lineales con o sin ramificaciones, o estructuras cíclicas. Por ejemplo, se tiene la siguiente imagen:
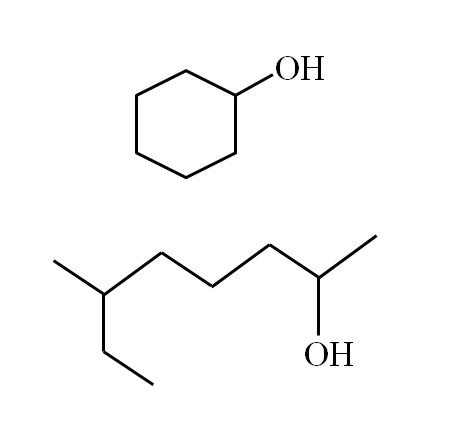
Nótese que para ambas estructuras hay algo en común: el OH está enlazado a una “V”. Cada extremo de la V representa un grupo R igual (parte superior de la imagen, estructura cíclica) o distinto (parte inferior, cadena ramificada).
De esta manera se identifica muy fácilmente cualquier alcohol secundario, aun si se desconoce su nomenclatura en absoluto.
- PROPIEDADES:
- PUNTOS DE EBULLICIÓN:
Las propiedades de los alcoholes secundarios físicamente no difieren demasiado de otros alcoholes. Suelen ser líquidos transparentes, y para ser un sólido a temperatura ambiente necesita formar varios puentes de hidrógeno y tener masa molecular alta.
No obstante, la misma fórmula estructural R2CHOH deja entrever ciertas propiedades únicas en general para estos alcoholes. Por ejemplo, el grupo OH se encuentra menos expuesto y disponible para las interacciones por puentes de hidrógeno, R2CH-OH—OHCHR2.
Esto se debe a que los grupos R, adyacentes al carbono portador del OH, pueden interponerse y dificultar la formación de los puentes de hidrógeno. Como resultado, los alcoholes secundarios tienen puntos de ebullición más bajos que los primarios (RCH2OH).
- ACIDEZ:
De acuerdo a la definición de Brönsted-Lowry, un ácido es aquel que dona protones o iones hidrógeno, H+. Cuando esto sucede con un alcohol secundario, se tiene:
R2CHOH + B– => R2CHO– + HB
La base conjugada R2CHO–, anión alcóxido, debe estabilizar su carga negativa. Para el alcohol secundario, la estabilización es menor ya que los dos grupos R poseen densidad electrónica, la cual repele en cierto grado la carga negativa sobre el átomo de oxígeno.
Mientras, para el anión alcóxido de un alcohol primario, RCH2O–, hay menor repulsión electrónica al haber solo un grupo R y no dos. Además, los átomos de hidrógeno no ejercen una repulsión significativa, y por el contrario, contribuyen a estabilizar la carga negativa.
Por lo tanto, los alcoholes secundarios son menos ácidos que los alcoholes primarios. Si esto es así, entonces son más básicos, y justamente por las mismas razones:
R2CHOH + H2B+ => R2CHOH2+ + HB
Ahora, los grupos R estabilizan la carga positiva en el oxígeno cediendo parte de su densidad electrónica.
REACCIONES:
- HALOGENURO DE HIDRÓGENO Y TRIHALOGENURO DE FÓSFORO
Un alcohol secundario puede reaccionar con un halogenuro de hidrógeno. Se muestra la ecuación química de la reacción entre el alcohol isopropílico y el ácido bromhídrico, en un medio de ácido sulfúrico, y produciendo bromuro de isopropilo:
CH3CHOHCH3 + HBr => CH3CHBrCH3 + H2O
Y también puede reaccionar con un trihalogenuero de fósforo, PX3 (X=Br, I):
CH3-CHOH-CH2-CH2-CH3 + PBr3 => CH3-CHBr-CH2-CH2-CH3 + H3PO3
La ecuación química de arriba corresponde a la reacción entre el Sec-pentanol y el tribromuro de fósforo, originando bromuro de sec-pentilo.
Nótese que en ambas reacciones se produce un halogenuro de alquilo secundario (R2CHX)
- DESHIDRATACION:
En esta reacción se pierde un H y un OH de carbonos vecinos, formándose un doble enlace entre estos dos átomos de carbono. Por lo tanto, hay la formación de un alqueno. La reacción requiere de un catalizador ácido y el suministro de calor.
Alcohol => Alqueno + H2O
Se tiene por ejemplo la siguiente reacción:
Ciclohexanol => Ciclohexeno + H2O
- REACCIONES CON METALES ACTIVOS:
Los alcoholes secundarios pueden reaccionar con los metales:
CH3-CHOH-CH3 + K => CH3CHO–K+CH3 + ½ H+
Aquí el alcohol isopropílico reacciona con el potasio para formar la sal isopróxido de potasio e iones hidrógeno.
- ESTERIFICACION:
El alcohol secundario reacciona con un ácido carboxílico para originar un éster. Por ejemplo, se muestra la ecuación química de la reacción del alcohol sec-butílico con el ácido acético, para producir acetato de sec-butilo:
CH3CHOHCH2CH3 + CH3COOH <=> CH3COOCHCH3CH2CH3
- OXIDACIÓN:
Los alcoholes primarios se oxidan a aldehídos, y estos a su vez se oxidan a ácidos carboxílicos. Pero, los alcoholes secundarios se oxidan a acetona. Las reacciones son usualmente catalizadas por dicromato de potasio (K2CrO7) y el ácido crómico (H2CrO4).
La reacción global es:
R2CHOH => R2C=O
NOMENCLATURA:
Los alcoholes secundarios se nombran señalando la posición del grupo OH en la cadena principal (más larga). Este número antecede el nombre, o puede ir después del nombre del alcano respectivo para dicha cadena.
Por ejemplo, el CH3CH2CH2CH2CHOHCH3, es el 2-hexanol o hexan-2-ol.
Si la estructura es cíclica, no hay necesidad de colocar un numerador; a menos, que haya otros sustituyentes. Por eso el alcohol cíclico de la segunda imagen se llama ciclohexanol (el anillo es hexagonal).
Y para el otro alcohol de la misma imagen (el ramificado), su nombre es: 6-etil-heptan-2-ol.
- ALCOHOL TERCIARIO:
Un alcohol terciario es aquel en el cual el grupo hidroxilo, OH, se halla enlazado a un carbono terciario. Su fórmula continúa siendo ROH, al igual que otros alcoholes; pero se le reconoce fácilmente porque el OH está cercano a una X en la estructura molecular. Asimismo, su cadena carbonada suele ser más corta, y su masa molecular mayor.
Entonces, un alcohol terciario tiende a ser más pesado, es más ramificado, y además es de todos el menos reactivo respecto a la oxidación; esto es, no puede transformarse en una cetona o ácido carboxílico como ocurre con los alcoholes secundarios y primarios, respectivamente.
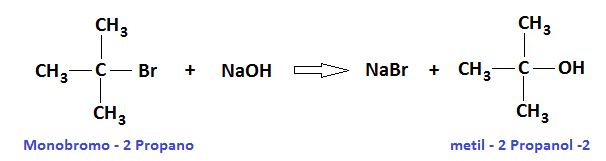
En la imagen superior se muestra la fórmula estructural general para un alcohol terciario. De acuerdo a ella, se pudiera escribir una nueva fórmula del tipo R3COH, donde R puede ser un grupo alquilo o arilo; un grupo metilo, CH3, o una cadena carbonada corta o larga.
Si los tres grupos R son diferentes, el carbono central del alcohol terciario será quiral; es decir, el alcohol presentará actividad óptica. Por este hecho los alcoholes terciarios quirales cobran interés dentro de la industria farmacéutica, pues a partir de cetonas con actividad biológica se sintetizan estos alcoholes con estructuras más complejas.
ESTRUCTURA:
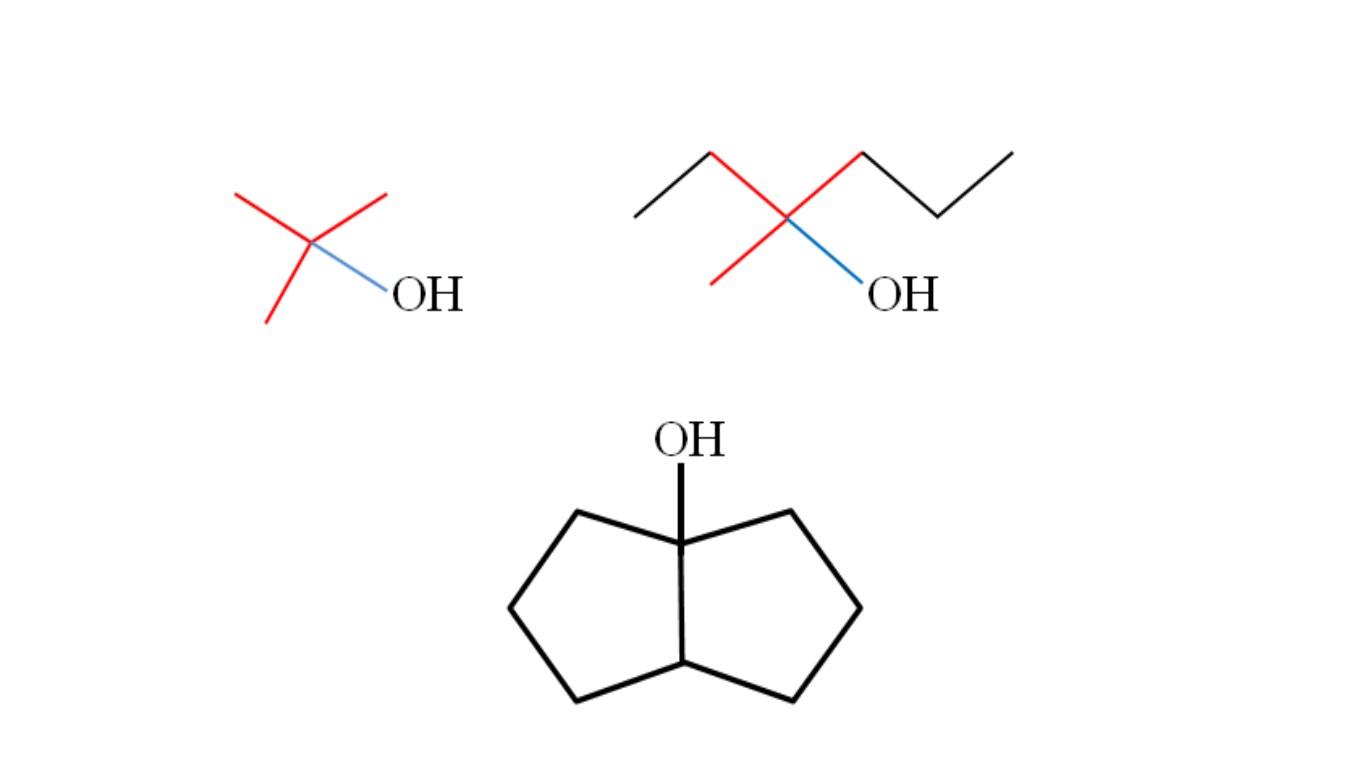
Considere las estructuras de los alcoholes terciarios superiores para aprender a reconocerlos sin importar cuál sea el compuesto. El carbono enlazado al OH debe también estar enlazado a otros tres carbonos. Si se observa detalladamente, los tres alcoholes cumplen con esto.
El primer alcohol (en la izquierda), consiste de tres grupos CH3 enlazados al carbono central, cuya fórmula vendría a ser (CH3)3COH. El grupo alquilo (CH3)3C- se conoce como tertbutilo, está presente en muchos alcoholes terciarios y puede reconocerse fácilmente por su forma de T (la T roja de la imagen).
El segundo alcohol (en la derecha), tiene enlazado al carbono central los grupos CH3, CH3CH2 y CH2CH2CH3. Como los tres grupos son diferentes, el alcohol es quiral y exhibe por ende actividad óptica. Aquí no se observa una T, sino una X cercano al OH (de color rojo y azul).
Y en el tercer alcohol (el de abajo y sin colores), el OH está enlazado a uno de los dos carbonos que unen dos ciclopentano. Este alcohol no presenta actividad óptica porque dos de los grupos enlazados al carbono central son idénticos. Al igual que el segundo alcohol, si se observa cuidadosamente se hallará también una X (más bien un tetraedro).
PROPIEDADES:
- FÍSICA:
Los alcoholes 3º presentan generalmente estructuras altamente ramificadas. Una primera consecuencia de esto es que el grupo OH se encuentra impedido, y por lo tanto, su momento dipolar ejerce un efecto menor sobre las moléculas vecinas.
Esto se traduce en interacciones moleculares más débiles en comparación a las de los alcoholes primarios y secundarios.
Por ejemplo, considérese los isómeros estructurales del butanol:
CH3CH2CH2OH (n-butanol, Peb = 117ºC)
(CH3)2CH2OH (alcohol isobutílico, peb = 107ºC)
CH3CH2CH(OH)CH3 (alcohol secbutílico, peb = 98ºC)
(CH3)3COH (alcohol tertbutílico, peb = 82ºC)
Nótese cómo descienden los puntos de ebullición a medida que el isómero se torna más ramificado.
Al principio se mencionó que en las estructuras de los alcoholes 3º se observan una X, la cual de por sí indica una alta ramificación. Es por eso que estos alcoholes tienden a tener puntos de fusión y/o ebullición menores.
Ligeramente similar es el caso para su miscibilidad con el agua. Mientras más impedido esté el OH menos miscible será el alcohol 3º con el agua. Sin embargo, dicha miscibilidad disminuye cuanto más larga sea la cadena carbonada; siendo así, el alcohol terbutílico es más soluble y miscible con el agua que el n-butanol.
- ACIDEZ
Los alcoholes terciarios tienden a ser los menos ácidos de todos. Las razones son numerosas y se relacionan entre sí. En resumidas cuentas, la carga negativa de su alcóxido derivado, RO–, sentirá una fuerte repulsión por los tres grupos alquilos enlazados al carbono central, debilitando al anión.
- REACTIVIDAD:
Los alcoholes 3º no pueden sufrir oxidaciones a cetonas (R2C=O) ni a aldehídos (RCHO) o ácidos carboxílicos (RCOOH). Por un lado, tendría que perder uno o dos carbonos (en forma de CO2) para oxidarse, lo cual disminuye su reactividad frente a la oxidación; y por el otro, carece de hidrógeno que pueda perder para formar otro enlace con el oxígeno.
No obstante, sí pueden sufrir sustitución y eliminación (formación de un doble enlace, un alqueno u olefina).
NOMENCLATURA:
La nomenclatura para estos alcoholes no es diferente que la de los demás. Existen nombres comunes o tradicionales, y los nombres sistemáticos regidos por la IUPAC.
Si la cadena principal y sus ramificaciones consisten de un grupo alquilo reconocido, este se utiliza para su nombre tradicional; cuando no es posible hacerlo, se recurre a la nomenclatura IUPAC.
FENOLES
Los fenoles como dijimos, son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH.
El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.
Si existen 2, 3 o más grupos OH se denominaran difenoles, trifenoles o polifenoles respectivamente. Cuando los sustituyentes del anillo estan vecinos se los llama con el prefijo orto (o). Si hay un lugar de separación entre ellos es meta (m) y si estan en lados opuestos para (p).

El fenol no existe en estado libre.
Se forma en la destilación seca de la hulla. Luego se destilan los aceites medios del alquitrán de hulla.
Por este método se obtiene poca cantidad. Por este motivo se lo prepara hoy sintéticamente.
A partir de la formación del ácido bencenosulfónico:
En la primera etapa el benceno reacciona con el ácido sulfúrico:
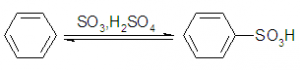
Este ácido formado después reacciona con el sulfito de sodio, dando como producto bencenosulfonato de sodio.
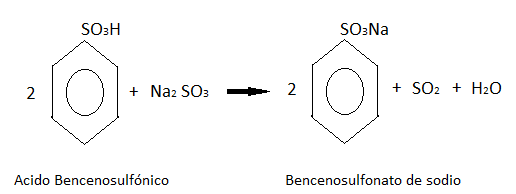
El bencenosulfonato de sodio después se concentra por evaporación y se combina con hidróxido de sodio.
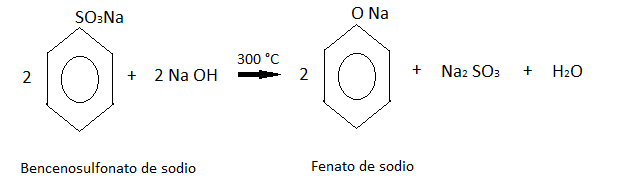
Este último producto se acidifica con dióxido de azufre de una de las reacciones anteriores, obteniendo finalmente al fenol.
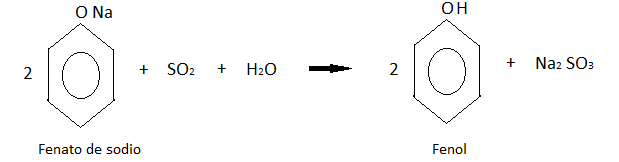
- PROPIEDADES DEL FENOL:
Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
Es poco soluble en agua. Muy soluble en éter y alcohol.
Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Con respecto a las reacciones, hay de dos tipos. Las que se relacionan con el grupo OH y aquellas en las que participa el anillo.
Formación de sales: El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.
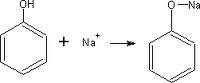
FENATO DE SODIO
Esta reacción si bien las presentan los alcoholes alifáticos, es más débil en estos. En el caso del fenol se da con mayor tendencia.
Formación de éteres: Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.
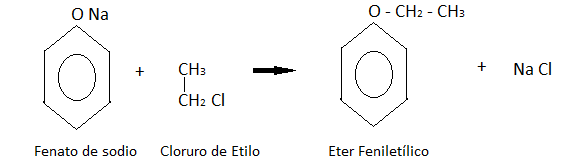
- FORMACIÓN DE ESTERES:
El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.
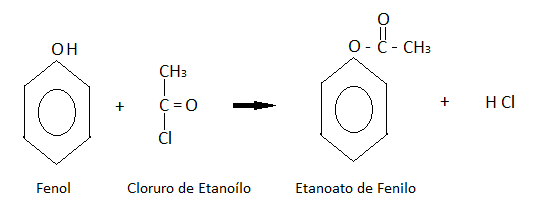
Entre las reacciones del anillo aromático, es decir, de sustitución, podemos nombrar las principales.
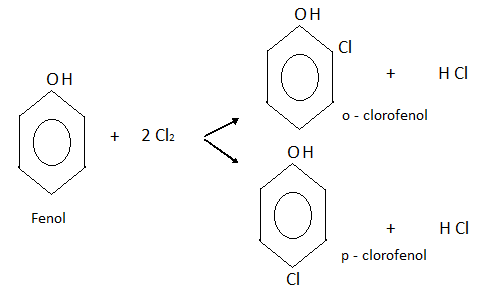
- HALOGENACION:
Haciendo reaccionar al fenol con cloro, por ejemplo, se obtiene una mezcla de o-clorofenol y p-clorofenol.
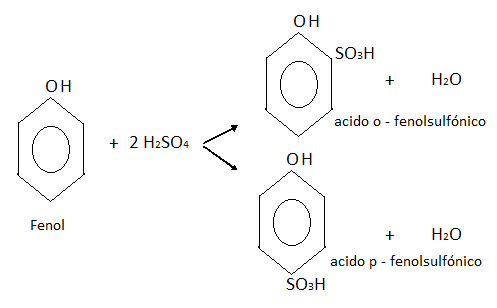
- SULFONACION:
El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.
- NITRACIÓN:
En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.
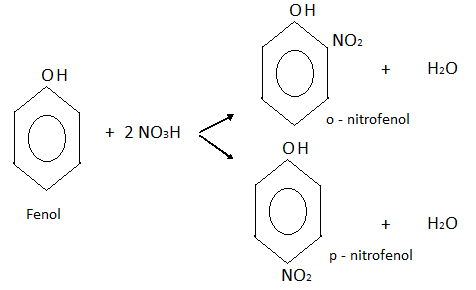
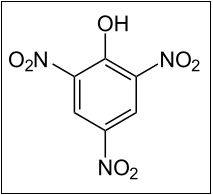
Si el ácido nítrico fuera más concentrado, obtendríamos el 2,4,6,-trinitrofenol también llamado ácido pícrico.
USOS DEL FENOL: Se usa para la fabricación de resinas sintéticas, ácido pícrico (usado a su vez para explosivos), ácido salicílico (materia prima para las aspirinas), colorantes, etc. Se ha usado mucho tiempo como agente antiséptico.
EJERCICIOS:
ALCOHOL 2
FENOL 1
FENOLES 2


BUEN TRABAJO 5,0
ResponderEliminar