HIDROCARBUROS AROMÁTICOS
ZAMANTA LEMUS ZAPATA
PRESENTADO A LA DOCENTE: DIANA FERNANDA JARAMILLO
CÁRDENAS
EN LA ASIGNATURA DE: QUÍMICA
GRADO:11-3
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
IBAGUE-TOLIMA
2018
INTRODUCCIÓN
- Son hidrocarburos derivados del benceno.
- El benceno se caracteriza por una inusual estabilidad, que le viene dada por la particular disposición de los dobles enlaces conjugados.
- Reciben este nombre debido a los olores intensos
OBJETIVOS
- Saber como se nombran los diferentes hidrocarburos
- Aprender a clasificar los hidrocarburos aromáticos
- Identificar como se numeran .
- Conocer el criterio de clasificación de los hidrocarburos aromáticos
- Conocer la diferente nomenclatura
MARCO TEÓRICO
Los hidrocarburos llamados aromáticos' forman una familia de compuestos que tienen un núcleo común, el núcleo del benceno. Por su estructura cíclica insaturada también se les llama arenos.
Su nombre deriva del siglo XIX, cuando se descubrieron varios compuestos que tenían aromas intensos ( bálsamos, esencias, resinas...) y todos tenían el núcleo bencénico.
Así pues, los compuestos aromáticos son derivados sustituidos del benceno o formados por la unión de varios núcleos bencénicos.
El exponente emblemático de la familia de los hidrocarburos aromáticos es el benceno (C6H6), pero existen otros.
La configuración aromático de seis átomos de carbono se denomina núcleo del benceno Los hidrocarburos aromáticos pueden ser monocíclicos o policíclicos.
Estructura
Resonancia del benceno. Cada carbono tiene tres electrones enlazados y el cuarto localizado gira alrededor del anillo.
Una característica de los hidrocarburos aromáticos como el bencenoes es la resonancia, debida a la estructura electrónica de la molécula. Al dibujar el anillo del benceno se le ponen tres enlaces dobles y tres enlaces simples. Dentro del anillo no existen en realidad dobles enlaces conjugados resonantes, sino que la molécula es una mezcla simultánea de todas las estructuras, que contribuyen por igual a la estructura electrónica.
Todos los derivados del benceno, siempre que se mantenga intacto el anillo, se consideran aromáticos. La aromaticidad puede incluso extenderse a sistemas policíclicos, como:
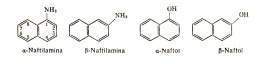
NAFTALENO:
El naftaleno, C10H8, es una de las sustancias que se obtienen del alquitrán de hulla en mayor cantidad. Se encuentra también en pequeñas cantidades en el petróleo de diversas procedencias y destila en la fracción del kerosene, pero no es obtenido de esta fuente en cantidades industriales.
PROPIEDADES:
Es un sólido blanco que cristaliza en placas brillantes de temperatura de fusión 80.27 °C; temperatura de ebullición 218 °C. Su presión de vapor es apreciable a temperatura ambiente y destila fácilmente en corriente de vapor. Se purifica habitualmente por sublimación.
ESTRUCTURA
El naftaleno posee propiedades similares a las del benceno. La fórmula de anillos condensados está de acuerdo con las siguientes observaciones experimentales: a) El análisis y la determinación del peso molecular indican que la fórmula molecular es C10H8. b) Tiene dos productos monosustituidos, isómeros, C10H7X, y diez productos di sustituidos isómeros del tipo C10H6X 2. Ninguno de estos derivados presenta isomería geométrica u óptica. c) Se comporta como una molécula simétrica y su momento dipolar es cero. d) La oxidación produce ácido ftálico; por consiguiente la molécula debe tener un anillo bencénico con dos cadenas laterales en orto. e) La oxidación del I-nitronaftaleno da ácido nitroftálico.
ESTRUCTURA ELECTRÓNICA:
El naftaleno es un híbrido de resonancia de tres estructuras contribuyentes principales. Su energía de resonancia es de 61 kcal/mol. La molécula es plana y de acuerdo con la teoría de los orbitales, tiene diez electrones Pi rodeando a los dos anillos condensados, por lo cual se clasifica como hidrocarburo aromático. La medida de las distancias entre los átomos de carbono por medio de rayos X muestra que, en contraste con el benceno, los átomos de carbono no están igualmente espaciados alrededor del sistema de anillos.
REACCIONES:
oxidación, reducción, halogenación, nitración y sulfonación
Oxidación
La oxidación da ácido ftálico.
HALOGENACION:
Tanto el Cloro como el Bromo reaccionan rápidamente con el naftaleno, sin necesidad de un catalizador como se requiere en la halogenación del Benceno, dando buenos rendimientos de alfa cloro y alfa bromonaftaleno, con desprendimiento de Cloruro de Hidrógeno. A menudo se utiliza el Tetracloruro de Carbono como solvente del naftaleno durante el proceso de halogenación.
NITRACION:
la misma da exclusivamente alfa nitronaftaleno. El beta nitronaftaleno puede obtenerse por nitración de la alfa naftilamina y la posterior desaminación por diazotación. En esta el sustituyente entra solo en la posición alfa.
SULFONACION:
En esta el sustituyente puede dirigirse mediante el control de la temperatura, de modo de obtener el ácido alfa o beta naftalenosulfónico. A 70 -80° C, el ácido sulfúrico concentrado convierte el naftaleno en ácido beta naftelenosulfónico
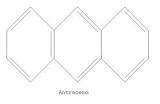
ANTRACENO:
Antraceno es un hidrocarburo tricíclico que se encuentra en la fracción de elevado punto de ebullición del destilado de alquitrán de hulla, fue descubierto por Antoine Laurent y Jean Dumas en 1832. Su formula química es C14 H10.
ESTRUCTURA:
Cuatro estructuras principales contribuyen al estado híbrido de la molécula de antraceno, la aplicación de la teoría de los orbitales, lleva a la conclusión que nubes de electrones están parcialmente supuesta y se encuentran por encima y por debajo del plano molecular. La sustancia pura cristaliza el benceno en laminillas brillantes con fluorescencia azul. Funde a 217o C, hierve a 355o C Y forma un picrato que funde a 138o C.
REACCIONES:
El antraceno es particularmente susceptible a la sustitución o adición en las posiciones 9 y 10. Por ejemplo la bromación produce 9- bromoantraceno y 9,10- dibromoantraceno; la hidrogenación da fácilmente 9,10- dihidroantraceno y la oxidación con solución de dicromato acidificada, produce antraquinona. La facilidad de reacción en la posición 9 o 10 cuando la molécula sufre un ataque electrófilico, está ligada indudablemente con la estabilidad del ión de transición que se forma. Así, un reactivo del tipo A + B – puede reaccionar con el antraceno para dar un producto de sustitución en 9 o un producto de adición en 9
FENANTRENO:
El fenantreno es un hidrocarburo (posee en su estructura carbono e hidrógeno) cuyas propiedades tanto físicas como químicas son estudiadas por la química orgánica. Pertenece al grupo de los llamados compuestos aromáticos, cuya unidad estructural fundamental es el benceno.
A los aromáticos también pertenecen los compuestos policíclicos fusionados, formados por varios anillos aromáticos que comparten un enlace carbono-carbono (C-C). El fenantreno es uno de estos, presenta en su estructura tres anillos fusionados. Se le considera isómero del antraceno, compuesto que tiene sus tres anillos fusionados en forma lineal.
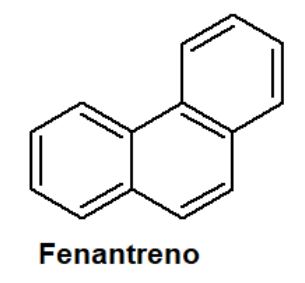
ESTRUCTURA QUÍMICA:
El fenantreno tiene una estructura química conformada por tres anillos bencénicos fusionados entre sí mediante un enlace carbono-carbono.
Se considera una estructura aromática porque cumple con la Ley de Hückle para la aromaticidad, que dice: “Un compuesto es aromático, si tiene 4n+2 electrones pi (π) deslocalizados y conjugados (alternados), con los electrones sigma (σ) de los enlaces simples.
PROPIEDADES FISICAS Y QUIMICAS:
-Densidad 1180 kg/m3; 1,18 g/cm3
-Punto de fusión 489,15 K (216 °C)
-Punto de ebullición 613,15 K (340 °C)
Las propiedades de un compuesto son las características o cualidades que permiten diferenciarlo de otros. Las propiedades que se miden a un compuesto son las propiedades físicas y las propiedades químicas.
Aunque el fenantreno es la forma isomérica del antraceno, sus propiedades son muy diferentes, confiriéndole al fenantreno mayor estabilidad química debido a la posición angular de uno de sus anillos aromáticos.
TIPOS DE HIDROCARBUROS AROMÁTICOS:
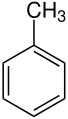
MONOSUSTITUIDOS:
Resultan de la sustitución de un hidrógeno del anillo bencénico por restos hidrocarbonados que se denominan cadenas laterales. En este caso el anillo bencénico se representa como C6H5-, fórmula que corresponde a un benceno que ha perdido un hidrógeno y en cuyo lugar existe otro sustituyente.
Se conocen muchos derivados de sustitución del benceno. Cuando se trata de los compuestos monosustituidos, las posiciones en el anillo bencénico son equivalentes.
Se nombra el sustituyente antes de la palabra benceno.
Nota: Algunos compuestos tienen nombres tradicionales aceptados
DISUSTITUIDOS:
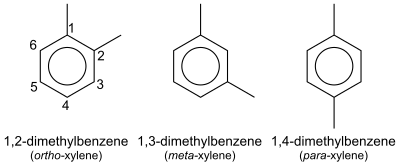
Cuando el anillo bencénico tiene dos hidrógenos sustituidos sus posiciones relativas se indican mediante números o prefijos. Tomando como ejemplo el dimetilbenceno o xileno.
Se nombran con los términos:
- o- (que se lee orto) para la disustitución en posiciones contiguas, 1 y 2 (también sería 1,2-dimetilbenceno);
- m- (meta) para las posiciones 1 y 3 (1,3-dimetilbenceno)
- y p- (para) para las posiciones 1 y 4 (1,4-dimetilbenceno)
POLISUSTITUIDOS:
Si hay más de dos grupos en el anillo benceno sus posiciones se deben indicar mediante el uso de números, la numeración del anillo debe ser de modo que los sustituyentes tengan el menor número de posición.
Ejemplos: En el hidrocarburo trisustituido, será 1,2,4-trimetilbenceno (se comienza a numerar el anillo de forma que resulte la combinación de números más baja posible, es decir, 1,2,4- y no 1,3,6- ni 1,4,5-, etc.[1]

POLICICLICOS:
También existen hidrocarburos aromáticos formados por la unión de varios anillos bencénicos (polinucleares) como el naftaleno una de cuyas formas resonantes
Para nombrar a este tipo de compuestos se indica el número de posición de los sustituyentes, seguido del nombre del sustituyente y seguido del nombre del compuesto.
El orden de numeración de estos compuestos es estricto, no se puede alterar y por ende tienen nombres específicos.

PANTALLAZOS:
BUEN TRABAJO 4,8
ResponderEliminar